En Segundo de Bachillerato estamos estudiando la estructura de la materia. Hemos analizado la evolución de los modelos atómicos a lo largo de la historia.
Hemos partido de las primeras ideas atomistas de los filósofos griegos Leucipo y Demócrito hasta el modelo mecanocuántico de Schrödinger, pasando por la Teoría Atómica de Dalton, el modelo de Thomson, el modelo de Rutherford y el modelo atómico de Bohr.
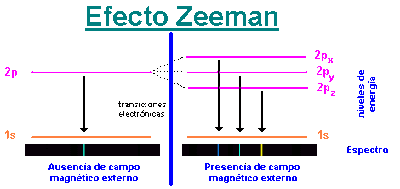
El modelo de Bohr es un modelo de transición. En sus postulados utiliza conceptos de la Física Clásica y de la Física Cuántica. Por ello, hemos introducido algunas ideas básicas de la Física Cuántica como son la hipótesis de Planck, el efecto fotoeléctrico y los espectros atómicos.
En 1888 Heinrich Hertz descubrió que cuando una luz incide sobre ciertas superficies metálicas, éstas emiten electrones.
Esta emisión cumple una serie de características:
1. La emisión de electrones solo se produce cuando se alcanza una frecuencia mínima denominada frecuencia umbral. Por debajo de esa frecuencia, que es característica para cada metal, no se produce emisión de electrones.
2. La velocidad de los electrones emitidos solo depende de la frecuencia de la radiación incidente y no de su intensidad; de ésta depende el número de electrones emitidos.
3. No existe un tiempo de retraso entre la radiación incidente y la emisión de electrones.
En 1905, Albert Einstein propuso que la luz está constituida por una serie de partículas elementales, denominadas fotones, cuya energía viene dada por la ecuación de Planck:
Los electrones serán arrancados cuando se les proporcione la energía suficiente para liberarse de su interacción con el resto del átomo. Esta es la energía mínima que se relaciona con la frecuencia umbral. Si la frecuencia de la radiación incidente es menor que la frecuencia umbral, los electrones no serán arrancados. Si la frecuencia incidente es mayor que la umbral, además de arrancarse los electrones, saldrán del metal con cierta velocidad, esto se debe a que la energía incidente es mayor que la necesaria para arrancar los electrones y la energía sobrante sirve para que los electrones adquieran energía cinética y puedan salir con una velocidad proporcional a dicha energía.
El efecto fotoeléctrico es la base del funcionamiento de las células fotoeléctricas. Entre el ánodo y el cátodo hay una pequeña diferencia de potencial para que los electrones que se arrancan sigan el camino de la corriente eléctrica.
Las células fotoeléctricas están presentes en muchos objetos cotidianos, por ejemplo, el sistema de apertura y cierre de las puertas de los ascensores se basa en esta efecto.
A Albert Einstein se le concedió el premio Nobel de Física en 1921 por el descubrimiento de la ley del efecto fotoeléctrico y no por su conocida teoría de la relatividad. Resulta curioso que tardasen tanto tiempo en considerarle merecedor del premio, dado que la ley del efecto fotoeléctrico se publicó en 1905.
Ese mismo año también publicó la teoría de la relatividad especial que trata de la física del movimiento de los cuerpos en ausencia de fuerzas gravitatorias, en el que se hacen compatibles las ecuaciones de Maxwell del electromagnetismo con una reformulación de las leyes del movimiento.
La teoría de la relatividad general, publicada en 1915, es una teoría de la gravedad que reemplaza a la gravedad newtoniana, aunque coincide numéricamente con ella para campos gravitatorios débiles y "pequeñas" velocidades. Esta teoría explica que la materia deforma el espacio-tiempo. Indica que la gravedad es una consecuencia de la curvatura espacio tiempo.
Además de tardar mucho tiempo en concederle el premio, resulta raro que no fuese por la teoría de la relatividad , sin quitar mérito a su aporte al efecto fotoeléctrico. En la teoría de la relatividad se introduce un cambio radical en la concepción del espacio, el tiempo y la energía.
A la comunidad científica le constó aceptar estas nuevas ideas, tachándolas más de filosóficas que de científicas, pues se mostraban alejadas del orden y el absoluto estudiado hasta ahora. En principio no existían muchas evidencias experimentales que corroborasen la teoría. En 1919, las observaciones de un eclipse total de Sol confirmaron las predicciones relativistas sobre la curvatura de la luz.
La teoría contenía una predicción espectacular: la luz también poseía "peso", debía ser atraída y desviada por los cuerpos celestes. La equivalencia entre la aceleración y la gravedad se extiende a los fenómenos electromagnéticos y la luz es una onda electromagnética,los rayos luminosos deberían curvarse en presencia de un campo gravitatorio. Einstein se dio cuenta de que la única forma de verificar experimentalmente su predicción era durante un eclipse total de Sol que permitiría fotografiar una estrella cercana al Sol, sin la presencia de la potente luz solar.
El eclipse fue fotografiado por Eddintong. Sacó fotografías de las estrellas cercanas al Sol, y éstas aparecieron desplazadas debido a la curvatura de la luz predicha por Einstein. La dificultad en la realización del experimento y la tecnología de la época llevaron a considerar los resultados como ambiguos, aunque esta comprobación de la teoría contó con el apoyo de Planck, Bohr y Lorentz, que inicialmente se había mostrado escéptico ante las ideas relativistas. Análisis modernos han vuelto a confirmar la exactitud en los datos medidos por Eddintong en sus fotografías.
Las nominaciones al Premio Nobel para Einstein se sucedían, pero el premio no llegaba. En 1920, el físico antisemita Philipp Lenard, Premio Nobel de Física en 1905, catalogó la teoría como una conjura filosófica propia de la ciencia judía. La Academia seguía argumentando que el premio se daba a descubrimiento o invenciones y la relatividad no se encuadraba dentro de ninguna de estas definiciones.
El prestigio de Einstein aumentaba dentro de la comunidad científica y además era un físico famoso entre el público en general, así que en noviembre de 1922 se le comunicó a Einstein que se le otorgaba el Premio Nobel de 1921 por su descubrimiento del efecto fotoeléctrico. Así la academia evitó la polémica y la controversia que había rodeado a la teoría relativista. De todas maneras, en el discurso por la aceptación del premio, el científico incluyó sus ideas de la relatividad.
No es un hecho aislado, el rechazo de algunos científicos a estas ideas revolucionarias, también provocado quizás por el origen judío del físico. Einstein ha tenido algunos detractores. En 1931 se publicó el terrible libro "Cien autores contra Einstein", escrito por intelectuales afines a Hitler para desacreditar sus investigaciones científicas. Cuando le preguntaron qué pensaba de este libro, contestó:"Si yo estuviese equivocado, uno solo habría sido suficiente"